MINI RECENZIA
Základňa proti rakovine: univerzálne markery iba rakoviny
Chengchen Qian1, Xiaolong Zou2, Wei Li1,3, Yinshan Li4, Wenqiang Yu5
1Shanghai Epiprobe Biotechnology Co., Ltd, Shanghai 200233, Čína;2 Oddelenie všeobecnej chirurgie, Prvá pridružená nemocnica Harbinskej lekárskej univerzity, Harbin 150001, Čína;3Shandong Epiprobe Medical Laboratory Co., Ltd, Heze 274108, Čína;4 Ľudová nemocnica autonómnej oblasti Ningxia Hui, Ningxia Medical University, Yinchuan 750002, Čína;5Shanghai Public Health Clinical Center & Department of General Surgery, Huashan Hospital & Cancer Metastasis Institute & Laboratory of RNA Epigenetics, Institutes of Biomedical Sciences, Shanghai Medical College, Fudan University, Shanghai 200032, China
ABSTRAKT
Rakovina je hlavnou príčinou úmrtí na celom svete.Včasné odhalenie rakoviny môže znížiť úmrtnosť všetkých typov rakoviny;pre väčšinu typov rakoviny však chýbajú účinné biomarkery včasnej detekcie.Metylácia DNA bola vždy hlavným cieľom záujmu, pretože k metylácii DNA zvyčajne dochádza pred inými detekovateľnými genetickými zmenami.Pri skúmaní spoločných znakov rakoviny pomocou nového sekvenovania určovania polohy pre metyláciu DNA sa séria univerzálnych markerov iba pre rakovinu (UCOM) ukázala ako silní kandidáti na účinnú a presnú včasnú detekciu rakoviny.Zatiaľ čo klinická hodnota súčasných biomarkerov rakoviny je znížená nízkou citlivosťou a / alebo nízkou špecifickosťou, jedinečné vlastnosti UCOM zaisťujú klinicky zmysluplné výsledky.Validácia klinického potenciálu UCOM pri rakovine pľúc, krčka maternice, endometria a urotelu ďalej podporuje aplikáciu UCOM pri viacerých typoch rakoviny a rôznych klinických scenároch.V skutočnosti sú aplikácie UCOM v súčasnosti aktívne skúmané s ďalším hodnotením pri včasnej detekcii rakoviny, pomocnej diagnostike, účinnosti liečby a monitorovaní recidívy.Molekulárne mechanizmy, ktorými UCOM detegujú rakovinu, sú ďalšími dôležitými témami, ktoré sa majú skúmať.Aplikácia UCOM v scenároch reálneho sveta si tiež vyžaduje implementáciu a zdokonalenie.
KĽÚČOVÉ SLOVÁ
detekcia rakoviny;skríning rakoviny;metylácia DNA;epigenetika rakoviny;biomarkery rakoviny
Prečo naliehavo potrebujeme nové biomarkery?
Po vyše storočnom boji proti rakovine je rakovina stále najsmrteľnejšou biologickou hrozbou pre ľudstvo.Rakovina zostáva celosvetovým zdravotným problémom s 19,3 miliónmi nových prípadov a takmer 10 miliónmi úmrtí odhadovaných v roku 20201. Odhaduje sa, že v roku 2020 bolo v Číne diagnostikovaných 4,6 milióna nových prípadov rakoviny, čo predstavuje 23,7 % nových prípadov rakoviny na celom svete podľa GLOBOCAN1.Okrem toho sa v roku 2020 v Číne pripísali približne 3 milióny úmrtí na rakovinu, čo predstavuje 30 % celosvetových úmrtí súvisiacich s rakovinou1.Tieto štatistiky ukázali, že Čína je na prvom mieste v incidencii a úmrtnosti na rakovinu.Navyše 5-ročná miera prežitia pri rakovine je 40,5 %, čo je 1,5-krát menej ako 5-ročná miera prežitia v Spojených štátoch2,3.Pomerne nižšie miery prežitia a vyššia miera úmrtnosti v Číne ako v krajinách s vyšším indexom ľudského rozvoja naznačujú, že je naliehavo potrebný účinný a nákladovo efektívny systém prevencie a sledovania rakoviny.Včasné odhalenie rakoviny je jedným z najdôležitejších prvkov v systéme zdravotnej starostlivosti.Včasná detekcia rakoviny môže zlepšiť prognózu a prežitie v skorom štádiu takmer všetkých typov rakoviny4.Úspešné skríningové stratégie viedli k významnému poklesu incidencie a úmrtnosti na rakovinu krčka maternice, prsníka, hrubého čreva a konečníka a rakoviny prostaty.
Dosiahnuť včasné odhalenie rakoviny však nie je ľahká úloha.Skúmanie biológie a prognózy včasnej rakoviny, identifikácia a overovanie spoľahlivých biomarkerov včasnej detekcie a vývoj dostupných a presných technológií včasnej detekcie boli vždy najväčšími prekážkami v tomto procese4.Presná detekcia rakoviny dokáže rozlíšiť benígne lézie od malígnych, čo pomáha vyhnúť sa zbytočným procedúram a uľahčuje ďalší manažment ochorenia.Súčasné stratégie včasnej detekcie zahŕňajú biopsie založené na endoskope, lekárske zobrazovanie, cytológiu, imunotesty a testy biomarkerov5-7.Endoskopické biopsie, ktoré sú rušivé a nákladné, nesú vo svojej podstate veľké bremeno ako hlavný lekársky postup, ktorý sa spolieha na profesionálny personál.Podobne ako pri cytológii, obe skríningové metódy závisia od lekárov a sú založené na osobnom úsudku s výkonom, ktorý je ďaleko od ideálu8.Na rozdiel od toho sú imunotesty veľmi nepresné vzhľadom na vysokú mieru falošne pozitívnych výsledkov.Lekárske zobrazovanie ako skríningová taktika vyžaduje drahé vybavenie a špecializovaných technikov.Medicínske zobrazovanie je preto extrémne obmedzené kvôli nízkej dostupnosti.Zo všetkých týchto dôvodov sa biomarkery javia ako lepšia možnosť na včasnú detekciu rakoviny.
Korešpondencia s: Yinshan Li a Wenqiang Yu
Email: liyinshan@nxrmyy.com and wenqiangyu@fudan.edu.cn
ID ORCID: https://orcid.org/0009-0005-3340-6802 a
https://orcid.org/0000-0001-9920-1133
Prijaté 22. augusta 2023;prijaté 12. októbra 2023;
zverejnené online 28. novembra 2023.
Dostupné na www.cancerbiomed.org
©2023 Biológia a medicína rakoviny.Creative Commons
Medzinárodná licencia Attribution-NonCommercial 4.0
Biomarkery sú v súčasnosti kategorizované ako proteíny, markery mutácie DNA, epigenetické markery, chromozomálne abnormality, markery RNA odvodené priamo z nádorov alebo fragmenty nádorov získané nepriamo z telesných tekutín.Proteínové markery sú najrozšírenejšie biomarkery pri skríningu a diagnostike rakoviny.Proteínové biomarkery, ako skríningové biomarkery, sú obmedzené tendenciou byť ovplyvnené benígnymi léziami, čo vedie k nadmernej diagnóze a nadmernej liečbe, ako sa uvádza v prípade α-fetoproteínu a prostatického špecifického antigénu (PSA)9,10.RNA markery zahŕňajú vzory genetickej expresie a iné nekódujúce RNA markery. Kombináciu markerov genetickej expresie RNA možno detegovať pomocou vzoriek moču, ktorých citlivosť nebola zďaleka uspokojivá (60 %) pre primárne nádory a ktorých detekcia môže byť byť ovplyvnené ľahkou degradovateľnosťou RNA v normálnom prostredí11.Genetické aj epigenetické markery čelia problému prevalencie v nádoroch a obmedzenia na typy rakoviny.
Metylácia DNA je silným kandidátom na biomarker včasnej detekcie, odkedy ju Feinberg prvýkrát spojil s rakovinou v roku 198312. Aberácie metylácie DNA sa pozorujú vo všetkých štádiách rakoviny, už v predrakovinovom štádiu.Aberantná hypermetylácia DNA zvyčajne prebieha na ostrovoch CpG v génových promótoroch, aby pôsobili proti supresorom nádorov13, 14.Štúdie tiež naznačujú, že abnormálna hypermetylácia DNA sa podieľa na regulácii vývojových regulátorov15.Údolie metylácie DNA, ktoré sa bežne spája s vývojovými regulátormi a hypermetylovanými rakovinami, môže prepnúť režim génovej expresie na stabilnejší režim závislý od metylácie DNA a znížiť spojenie s metylovaným histónom H3K27me3 a súvisiacimi polycomb proteínmi16, 17.
Spomedzi veľkého počtu publikovaných markerov metylácie DNA niekoľko úspešne debutovalo na trhu;Súčasné komercializované markery metylácie DNA a diagnostické panely však musia z viacerých dôvodov úplne uvoľniť potenciál včasnej detekcie rakoviny18.Zatiaľ čo väčšinou vykazujú prijateľnú výkonnosť pomocou databázových informácií, tieto biomarkery zvyčajne fungujú menej ideálne v reálnom svete kvôli skutočnosti, že vzorky z reálneho sveta sú často zložitejšie a nie také reprezentatívne ako tie, ktoré sú vybrané v databázach.Ukázalo sa, že skorá detekcia multirakovinovej metylácie založenej na sekvenovaní ďalšej generácie má len 16,8 % a 40,4 % senzitivitu pri rakovine štádia I a II19.Testy včasnej detekcie vyžadujú väčšiu stabilitu a presnejšie biomarkery.
Objavenie univerzálneho markera rakoviny (UCOM) pomocou sekvenovania určovania polohy (GPS)
Napriek desaťročiam výskumu rakoviny sa nepodarilo dosiahnuť uspokojivú prevenciu a liečbu.Sú potrebné nové metodológie, ktoré umožnia výskumníkom dôkladne vyhodnotiť rakovinu.Za posledných 23 rokov sa 6 charakteristických znakov rakoviny, ako napríklad vyhýbanie sa apoptóze, invázia tkaniva a metastázy atď., rozšírilo na 14 zahrnutím funkcií, ako je nemutačné epigenetické preprogramovanie a polymorfné mikrobiómy20,21.S odhaľovaním ďalších podrobností týkajúcich sa rakoviny sa do výskumu rakoviny zavádza viac perspektív.Výskum rakoviny sa postupne zmenil v dvoch smeroch (spoločnosť a individualita).S rozvojom presnej onkológie v posledných rokoch sa ťažisko výskumu rakoviny prikláňa k individualizovanej cielenej terapii a heterogenite rakoviny22.Nedávno identifikované biomarkery rakoviny sa teda zamerali hlavne na špecifické typy rakoviny, ako je rakovina krčka maternice PAX623 a BMP3 pre kolorektálny karcinóm24.Výkon týchto biomarkerov špecifických pre typy rakoviny sa líši, ale stále nie je možné, aby vnímaví jedinci podstúpili skríning všetkých druhov rakoviny súčasne kvôli obmedzeniu získavania biologických vzoriek a vysokým nákladom.Ideálne by bolo, keby sme dokázali identifikovať jediný robustný biomarker, ktorý je účinný pre všetky typy rakoviny v ranom štádiu.
Na dosiahnutie takého ideálneho cieľa sa musí zo zoznamu potenciálnych typov biomarkerov vybrať lepší kandidát na biomarker.Je známe, že aberácie metylácie DNA, spomedzi všetkých genetických a epigenetických profilov, súvisia s rakovinou a sú jedny z prvých, ak nie prvých, abnormalít súvisiacich s rakovinou, ktoré sa vyskytujú chronologicky.Skúmanie metylácie DNA sa začalo skoro, ale bráni mu nedostatok výskumných metód.Medzi 28 miliónmi potenciálnych metylovaných CpG miest v genóme sa musí zistiť zvládnuteľný počet a zarovnať ho s genómom, aby sa lepšie porozumelo tumorigenéze.Bisulfitové sekvenovanie celého genómu (WGBS), ktoré sa považuje za zlatý štandard metylačného sekvenovania DNA, môže pokryť iba 50 % Cs v rakovinových bunkách kvôli povahe bisulfitovej liečby, ktorá rozbíja fragmenty DNA a znižuje zložitosť genómu počas transformácia Cs-na-Ts25.Iné metódy, ako napríklad 450k čipy, pokrývajú iba 1,6 % metylácie genómu.Na základe 450 000 údajov má panel na detekciu metylácie DNA 35,4 % citlivosť pre 6 typov rakoviny v štádiu I26.Obmedzenia typov rakoviny, slabý výkon a hluk generovaný detekčnými metódami v analytickom procese sa stali najväčšími prekážkami pre panely na detekciu rakoviny.
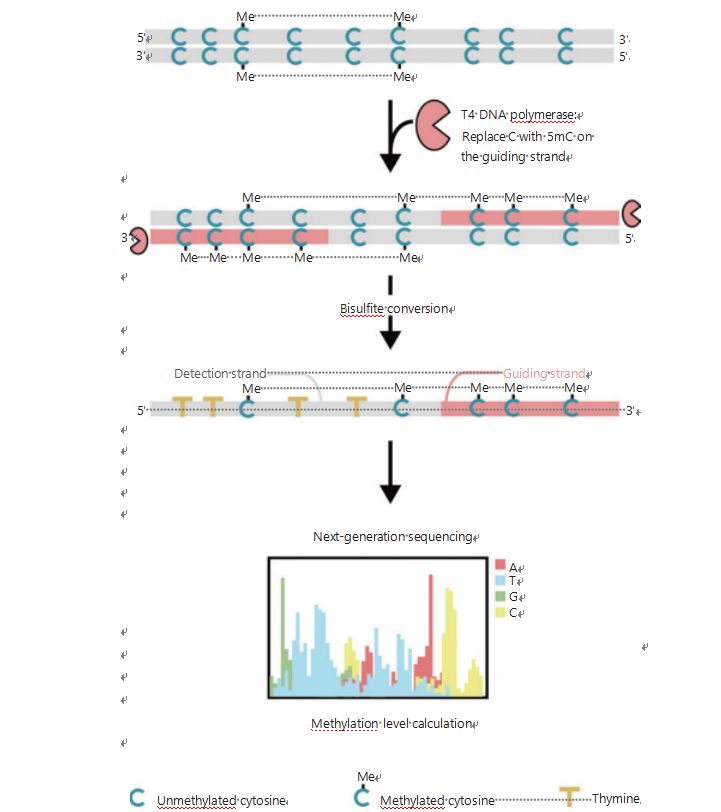
Aby sme lepšie preskúmali epigenetické vzorce buniek počas tumorigenézy a metastáz, vyvinuli sme jedinečný GPS na detekciu metylácie DNA v celom genóme, ktorý pokrýva až 96 % miest CpG pri 0,4 miliardách prečítaní25.GPS je bilaterálna sekvenčná metóda využívajúca 3' koniec DNA fragmentu nekonvertibilných metylcytozínov po bisulfitovej úprave, ktorá vedie zarovnanie výpočtu metylácie DNA na 5' konci pomocou párového sekvenovania (obrázok 1)25.Vodiace vlákno metyl-cytozínu, ktoré pôsobí ako templátový reťazec, pomáha pri zarovnaní oblasti s vysokým GC, ktoré obnovuje najviac opustené sekvenčné údaje v tradičnom WGBS.Funkcia vysokého pokrytia GPS poskytuje obrovské množstvo informácií o metylácii DNA, čo nám umožňuje skúmať profily metylácie rakoviny s výrazne vyšším rozlíšením v predtým nedostatočne skúmaných oblastiach.
GPS nám poskytuje výkonný nástroj na skúmanie homogenity rakoviny, ktorý môže výrazne zjednodušiť výskum rakoviny a potenciálne nájsť univerzálne vysvetlenie tumorigenézy a metastáz.Pri analýze údajov GPS o rakovinových bunkových líniách sa často vyskytoval jedinečný jav.Existovalo množstvo oblastí, ktoré sa zdali byť abnormálne hypermetylované vo viacerých typoch vzoriek rakoviny.Toto neočakávané zistenie bolo následne potvrdené, že slúži ako UCOM.Analyzovalo sa viac ako 7 000 vzoriek zo 17 typov rakoviny v databáze The Cancer Genome Atlas (TCGA), medzi ktorými sme identifikovali prvý UCOM, HIST1H4F, gén súvisiaci s histónom, ktorý je hypermetylovaný pri všetkých typoch rakoviny27.Séria UCOM bola potom nájdená a overená v databáze TCGA, v databáze Gene Expression Omnibus (GEO) a v skutočných klinických vzorkách.Doteraz boli HIST1H4F, PCDHGB7 a SIX6 nájdené a overené ako UCOM.Neočakávaný objav UCOM ponúka silnú odpoveď na potrebu včasnej detekcie rakoviny.UCOM poskytujú riešenie na detekciu viacerých rakovín pomocou jediného markera.
Charakteristika UCOM
Po validácii sa ukázalo, že UCOM vykazujú štyri hlavné charakteristiky, ktoré umožňujú UCOM prekonať účinnosť súčasných biomarkerov (obrázok 2).
Jedinečné pre malignitu
UCOM sú jedinečné pre rakovinové alebo prekancerózne lézie a nie sú ovplyvnené normálnymi fyziologickými zmenami.Niektoré zo súčasných markerov súvisiacich s rakovinou, ktoré sa široko používajú pri včasnej detekcii a/alebo skríningu, viedli k nadmernej diagnóze.Zvýšené hladiny PSA, klinicky akreditovaný skríningový nástroj, sa zisťujú aj pri benígnych stavoch, ako je hyperplázia prostaty a prostatitída10.Nadmerná diagnóza a následná nadmerná liečba vedie k zníženej kvalite života v dôsledku črevných, močových a sexuálnych komplikácií28.Iné a v klinickom prostredí široko používané biomarkery založené na proteínoch, ako napríklad CA-125, nepriniesli žiadne významné výhody, pričom sa prejavila nadmerná diagnóza a nadmerná liečba29.Vysoká špecifickosť UCOM pre malignity zabraňuje týmto nedostatkom.UCOM, PCDHGB7, účinne rozlišuje skvamózne intraepiteliálne lézie vysokého stupňa (HSIL) a rakovinu krčka maternice od normálnych vzoriek a skvamózne intraepiteliálne lézie nízkeho stupňa (LSIL), zatiaľ čo väčšina ostatných biomarkerov dokáže odlíšiť rakovinu krčka maternice od normálnych vzoriek30.Hoci PCDHGB7 nezisťuje významné rozdiely medzi normálnym endometriom a endometriálnou hyperpláziou, významné rozdiely sú zistené medzi normálnym endometriom a atypickou hyperpláziou a ešte väčšie rozdiely sú zistené medzi normálnym endometriom a endometriálnou rakovinou (EC) na základe PCDHGB731.UCOM sú jedinečné pre malígne lézie v databázach a klinických vzorkách.Z pohľadu pacienta jedinečné UCOM znižujú prah na pochopenie zložitých indikácií rôznych slabo fungujúcich nestabilných biomarkerov a zodpovedajúcej úzkosti počas procesu hodnotenia.Z pohľadu lekára unikátne UCOM odlišujú malignity od benígnych lézií, čo napomáha pri triedení pacientov a redukuje zbytočné medicínske postupy a nadmernú liečbu.Jedinečné UCOM preto znižujú nadbytočnosť medicínskeho systému, zmierňujú systémové ťažkosti a sprístupňujú viac medicínskych zdrojov tým, ktorí to potrebujú.
Obrázok 1 Schéma pracovného postupu GPS na detekciu metylácie DNA25.Sivá čiara: vstupná sekvencia DNA;červená čiara: DNA ošetrená T4 DNA polymerázou, nahradením cytozínu 5'-metylcytozínom na 3' konci vstupu;modré C s Me: metylovaný cytozín;modrá C: nemetylovaný cytozín;žltá T: tymín25.
Všetko alebo nič
UCOM sú prítomné iba v rakovinových bunkách a sú stabilne detegované takmer vo všetkých rakovinových bunkách.Bolo overené, že HIST1H4F je hypermetylovaný takmer vo všetkých typoch nádorov, ale nie v normálnych vzorkách27.Podobne sa tiež ukázalo, že PCDHGB7 a SIX6 sú hypermetylované vo všetkých vzorkách nádorov, ale nie v normálnych vzorkách30-32.Táto jedinečná vlastnosť výrazne zlepšuje výkon UCOM s ohľadom na limit detekcie a citlivosti.Vo vzorkách možno diferencovať len 2 % rakovinových buniek, vďaka čomu sú UCOM oveľa citlivejším biomarkerom ako väčšina existujúcich biomarkerov30. Ako biomarker používaný na detekciu kolorektálneho karcinómu existujú mutácie KRAS len v približne 36 % prípadov kolorektálneho karcinómu. čo naznačuje slabý diagnostický potenciál33.Nízka prevalencia mutácií KRAS pri kolorektálnom karcinóme limituje KRAS v kombinácii s inými biomarkermi.V skutočnosti sa kombinácia biomarkerov môže zdať spočiatku sľubná, ale nie vždy generuje uspokojivý výsledok, pričom vykazuje oveľa väčší šum v detekčnej analýze a zvyčajne zahŕňa komplikovanejšie experimentálne postupy.Naproti tomu PCDHGB7 a iné UCOM existujú vo všetkých rakovinách.UCOM detegujú rakovinové zložky v rôznych typoch vzoriek rakoviny s maximálnou presnosťou a zároveň eliminujú komplexné procesy analýzy rušenia hluku.Nie je ťažké odhaliť rakovinu v bohatej vzorke, ale je mimoriadne náročné odhaliť rakovinu v malej vzorke.UCOM sú schopné odhaliť malé množstvá rakoviny.
Obrázok 2 Charakteristika UCOM.
Detekcia rakoviny pred patologickými zmenami
UCOM môžu byť detekované v predrakovinovom štádiu pred patologickými zmenami.Ako epigenetické biomarkery sa abnormality UCOM vyskytujú v skoršom štádiu ako fenotypové abnormality a sú zistiteľné počas tumorigenézy, progresie a metastáz34,35.Citlivosť UCOM v priebehu času zvyšuje výkonnosť UCOM pri detekcii rakoviny v počiatočnom štádiu a predrakovinových lézií.Detekcia včasnej rakoviny na základe biopsií a cytológie môže byť náročná aj pre tých najskúsenejších patológov.Jediná biopsia získaná kolposkopiou bola hlásená ako pozitívna v 60,6 % vzoriek HSIL+.Pre viacnásobné lézie sú potrebné ďalšie biopsie na zvýšenie citlivosti36.Naproti tomu UCOM, PCDHGB7, má citlivosť 82 % pre vzorky HSIL+, čím prevyšuje citlivosť biopsií a väčšiny biomarkerov30.Metylačný marker, FAM19A4, má citlivosť 69 % pre CIN2+, čo je podobné cytológii, ale nedokáže odlíšiť CIN1 od normálnych vzoriek37.Ukázalo sa, že UCOM sú oveľa citlivejším biomarkerom včasnej detekcie.V porovnaní s patológmi založenými na skúsenostiach majú UCOM vynikajúcu citlivosť detekcie pre rakovinu v ranom štádiu, čo zase prispieva k zlepšeniu prognózy rakoviny a prežitia30.Okrem toho UCOM ponúkajú detekčnú platformu, ktorá je dostupná pre oblasti bez skúsených patológov a výrazne zlepšuje efektivitu detekcie.Vďaka jednotným postupom odberu vzoriek a detekcie poskytuje detekcia UCOM stabilné a ľahko interpretovateľné výsledky, ktoré lepšie vyhovujú skríningovému protokolu vyžadujúcemu menej odborného personálu a lekárskych zdrojov.
Ľahko odhaliteľné
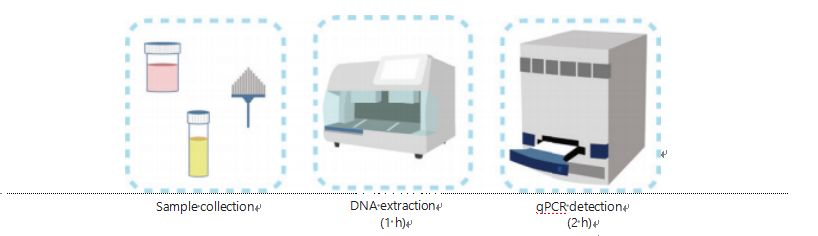
Súčasné metódy detekcie metylácie DNA sú komplikované a časovo náročné.Väčšina metód vyžaduje bisulfitovú transformáciu, ktorá spôsobuje stratu kvality vzorky a môže viesť k nestabilným a nepresným výsledkom.Zlá reprodukovateľnosť spôsobená bisulfitovou liečbou potenciálne vedie k zmätku pre lekárov a pacientov a ďalej zasahuje do následných a/alebo liečebných stratégií.Preto sme ďalej upravili metódu detekcie UCOM, aby sme sa vyhli problematickému bisulfitovému ošetreniu vzoriek, vyhoveli požiadavkám klinickej aplikácie a zlepšili dostupnosť.Vyvinuli sme novú metódu využívajúcu reštrikčné enzýmy citlivé na metyláciu v kombinácii s fluorescenčnou kvantitatívnou PCR v reálnom čase (Me-qPCR), aby sme kvantifikovali stav metylácie UCOM do 3 hodín pomocou jednoduchých manipulačných postupov (obrázok 3).Me-qPCR môže obsahovať viacero typov vzoriek, ako je klinický odber telesných tekutín a vzorky moču, ktoré sa odoberajú sami.Zozbierané klinické vzorky je možné spracovať, uložiť a jednoducho pristúpiť k detekcii pomocou štandardizovanej a automatizovanej extrakcie DNA.Extrahovaná DNA sa potom môže priamo aplikovať na platformu Me-qPCR pre reakciu v jednej nádobe a výsledky kvantifikácie výstupu.Po jednoduchej analýze výsledkov pomocou diagnostických modelov prispôsobených a overených špecifickým typom rakoviny sa konečné určenie výsledkov detekcie UCOM interpretuje a prezentuje ako semikvantitatívna hodnota.Platforma Me-qPCR prekonáva tradičné bisulfitové pyrosekvenovanie pri detekcii UCOM a zároveň šetrí 3 hodiny bisulfitovej konverzie podľa protokolu súpravy EZ DNA Methylation-Gold.Inovatívna platforma detekcie metylácie robí detekciu UCOM stabilnejšou, presnejšou a dostupnejšou30.
Obrázok 3 Proces detekcie UCOM.Typy vzoriek zahŕňajú profesionálne odobratý BALF, Pap kefku a/alebo samostatne odobratý moč.Proces extrakcie DNA môže byť prispôsobený automatickému extraktoru, ktorého produkt možno priamo detegovať pomocou qPCR.
Aplikácia UCOM
Rakovina pľúc
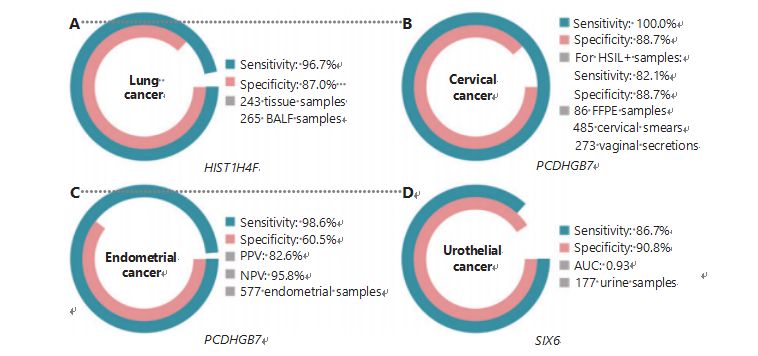
Rakovina pľúc je celosvetovo druhou najčastejšie diagnostikovanou a najsmrteľnejšou rakovinou, ktorá predstavuje 11,4 % nových prípadov a 18,0 % nových úmrtí1.Spomedzi všetkých diagnóz je 85 % nemalobunkový karcinóm pľúc (NSCLC) a 15 % malobunkový karcinóm pľúc (SCLC), ktorý má vyššiu úroveň malignity38.Skenovanie pomocou nízkodávkovej počítačovej tomografie (LDCT) je v súčasnosti odporúčanou metódou skríningu rakoviny pľúc a ukázalo sa, že zlepšuje včasnú detekciu a znižuje úmrtnosť6;v dôsledku nízkej špecificity a zlej dostupnosti však LDCT ešte musí slúžiť ako uspokojivá skríningová metóda, rovnako ako iné bežné markery rakoviny, ako je CEA39.Náklady a potenciál zmeškaných diagnóz a nesprávnych diagnóz stratégie skríningu LDCT bránia pokroku v propagácii skríningu rakoviny pľúc40.HIST1H4F, UCOM, má obrovský potenciál ako biomarker včasnej detekcie vo vzorkách bronchoalveolárnej tekutiny (BALF)27.HIST1H4F je hypermetylovaný pri pľúcnom adenokarcinóme a skvamocelulárnom karcinóme pľúc, so špecificitou detekcie 96,7 % a senzitivitou 87,0 % (obrázok 4A) a výnimočným výkonom pri rakovinách štádia I27.HIST1H4F má špecificitu 96,5 % a citlivosť 85,4 % pre NSCLC a 96,5 % a 95,7 % pre SCLC27.Okrem toho vzorky ôsmich ďalších typov rakoviny, vrátane rakoviny pankreasu a kolorektálneho karcinómu, potvrdili, že HIST1H4F je hypermetylovaný vo všetkých ôsmich typoch27.
Rakovina krčka maternice
Rakovina krčka maternice bola štvrtou najčastejšie diagnostikovanou rakovinou a štvrtou najčastejšou príčinou úmrtí na rakovinu u žien v roku 2020, čo predstavuje 3,1 % nových prípadov a 3,4 % úmrtí súvisiacich s rakovinou na celom svete1.Na odstránenie rakoviny krčka maternice do roku 2030, ako navrhuje WHO, je včasné odhalenie rakoviny krčka maternice nevyhnutnosťou.Ak sa zistí v skorom štádiu, 5-ročná miera prežitia dosiahne 92 % pri invazívnom karcinóme krčka maternice41.Smernice American Cancer Society (ACS) navrhujú cervikálne cytologické testy, primárne HPV testy alebo cotesty na skríning42.Cervikálna cytológia je invazívna a dokáže odhaliť len 63,5 % prípadov CIN2+37.
Na rozdiel od toho PCDHGB7 fungoval oveľa lepšie pri použití Pap náterov a vaginálnych sekrétov a môže účinne odlíšiť HSIL od LSIL v ultra skorom štádiu.Samotný PCDHGB7 má citlivosť 100,0 % a špecificitu 88,7 % pre rakovinu krčka maternice (obrázok 4B) a 82,1 % senzitivitu a 88,7 % špecificitu pre vzorky HSIL+30.PCDHGB7 má tiež 90,9 % senzitivitu a 90,4 % špecifickosť vo vzorkách vaginálneho sekrétu pre rakovinu krčka maternice, ktoré sa oveľa ľahšie zbierajú30.V kombinácii s vysokorizikovým (hr)HPV testom alebo Thinprep Cytologickým testom (TCT) má PCDHGB7 zvýšenú citlivosť 95,7 % a špecificitu 96,2 %, čím výrazne prevyšuje hrHPV test (20,3 %), TCT (51,2 %) a obe spolu (57,8 %) pre rakovinu krčka maternice30.Ukázalo sa tiež, že PCDHGB7 je hypermetylovaný v 17 typoch rakoviny z databázy TCGA, čo naznačuje jeho vhodnosť v rodine UCOM30.
Obrázok 4 UCOM boli potvrdené v štyroch typoch rakoviny v rozsiahlych klinických štúdiách.A. Výkon HIST1H4F, UCOM, pri detekcii rakoviny pľúc 508 vzoriek.B. Výkon PCDHGB7, UCOM, pri detekcii rakoviny krčka maternice u 844 vzoriek.C. Výkon PCDHGB7, UCOM, pri detekcii rakoviny endometria 577 vzoriek endometriálnej Pap a Tao kefky.D. Výkon SIX6, UCOM, pri detekcii uroteliálneho karcinómu 177 vzoriek.
EC
EC je jednou z najbežnejších rakovín ženského reprodukčného systému na celom svete, s odhadovaným počtom 4,2 milióna nových prípadov a 1 % úmrtí súvisiacich s rakovinou ročne1.Pri úspešnej diagnóze v ranom štádiu je EC liečiteľná a má 5-ročnú mieru prežitia 95 % pre rakovinu štádia I.Pacientky, ktoré sú symptomatické, ako je abnormálne maternicové krvácanie, dostávajú pravidelné klinické hodnotenie a podstupujú invazívne a bolestivé biopsie, napriek tomu, že len u 5 % – 10 % sa nakoniec vyvinie EC43.Transvaginálny ultrazvuk ako bežná detekčná metóda je vysoko nespoľahlivý pre svoju neschopnosť odlíšiť benígne a malígne endometriálne zmeny a vysokú mieru falošne pozitívnych výsledkov44.
Vykonalo sa paralelné porovnanie sérového CA-125, široko implementovaného EC biomarkera, a PCDHGB7.Sérový CA-125 mal senzitivitu 24,8 %, čo naznačuje, že CA-125 je neadekvátny marker pre EC napriek špecificite 92,3 %31.Detekcia PCDHGB7 pomocou vzoriek Pap kefiek poskytla citlivosť 80,65 % a špecificitu 82,81 % pre štádiá ECatall, zatiaľ čo kefka Tao mala citlivosť 61,29 % a špecificitu 95,31 %31.Diagnostický model PCDHGB7, založený na Me-qPCR, priniesol senzitivitu 98,61 %, špecificitu 60,5 % a celkovú presnosť 85,5 %, s použitím vzoriek štetcov Pap a Tao (obrázok 4C)31.
Uroteliálna rakovina
Uroteliálny karcinóm, pozostávajúci z karcinómu močového mechúra, obličkovej panvičky a močovodu, bol v roku 2020 celosvetovo siedmou najčastejšie diagnostikovanou rakovinou, ktorá spôsobila 5,2 % nových prípadov a 3,9 % úmrtí1.Uroteliálne rakoviny, z ktorých viac ako 50 % tvorí rakovina močového mechúra, boli štvrtou najčastejšie diagnostikovanou rakovinou v Spojených štátoch v roku 2022, čo predstavuje 11,6 % novodiagnostikovaných prípadov3.Približne 75 % rakovín močového mechúra je klasifikovaných ako neinvazívna rakovina močového mechúra obmedzená na sliznicu alebo submukózu45.Cystoskopická biopsia je zlatým štandardom na diagnostiku uroteliálneho karcinómu realizovaná fluorescenčnou in situ hybridizáciou (FISH) a cytologickými testami.FISH a cytológia majú slabý diagnostický výkon a cystoskopia je rušivá a má základné riziko chýbajúcich mikrolézií, nesprávnej interpretácie lézií a potenciálneho šírenia alebo relapsu rakoviny46.Ukázalo sa tiež, že predtým overený UCOM, PCDHGB7, je hypermetylovaný pri uroteliálnej rakovine, s plochou pod krivkou 0, 86, čo naznačuje potenciálnu diagnostickú schopnosť30.Na ďalšie overenie väčšieho počtu UCOM a lepšie prispôsobenie sa viacerým typom vzoriek sa skúmal SIX6, nový UCOM, ktorý ukázal vynikajúci diagnostický potenciál pri včasnej detekcii uroteliálnej rakoviny pomocou vzoriek moču na platforme Me-qPCR.Detekcia SIX6 pomocou vzoriek moču preukázala konkurenčnú citlivosť 86,7 % a špecificitu 90,8 % (obrázok 4D), pričom bola neinvazívna a ľahko sa získava32.V súčasnosti sa skúma potenciál SIX6 pri monitorovaní metastáz a hodnotení účinnosti liečby.
Budúcnosť a výzvy
UCOM majú silný výkon v diagnostickom potenciáli viacerých druhov rakoviny, ale zostáva ešte veľa práce.Rozširujeme zoznam UCOM a aktívne overujeme UCOM pri viacerých typoch rakoviny, vrátane tých, ktoré sa tradične ťažko detegujú.Výsledky validácie z databáz TCGA ďalej potvrdili aplikáciu UCOM vo viacerých typoch rakoviny a vo viacerých situáciách.V predbežnom výskume sa ukázalo, že UCOM majú silný diagnostický potenciál pre cholangiokarcinómy a adenokarcinómy pankreasu, ktoré je takmer nemožné diagnostikovať v ranom štádiu súčasnými skríningovými metódami32, 47.Schopnosť detegovať zriedkavé rakoviny pomocou UCOM možno využiť s cirkulujúcou nádorovou DNA (ctDNA) pomocou vylepšenej platformy tekutej biopsie48.Štúdia zahŕňajúca panel na detekciu pankancerózy na báze plazmovej DNA poskytla citlivosť 57,9 %49.Napriek vysokej špecifickosti celkový výkon prezrádza, že stále je čo zlepšovať.
Jedinečné vlastnosti UCOM tiež podporili skúmanie potenciálu UCOM pri hodnotení účinnosti liečby a monitorovaní recidívy.Podľa Response Evaluation Criteria in Solid Tumors (RECIST) je medicínske zobrazovanie odporúčanou metodikou na monitorovanie recidívy a hodnotenie účinnosti liečby, zatiaľ čo nádorové markery sa na hodnotenie používajú samostatne50.V skutočnosti sú však zobrazovacie prístupy výrazne ovplyvnené frekvenciou a načasovaním, a preto vystavujú pacientov vyššiemu riziku a nákladom51,52.SIX6 bol potvrdený, že slúži ako prediktor metastáz rakoviny prsníka32.Monitorovanie ctDNA na báze tekutej biopsie umožňuje sledovanie minimálnej reziduálnej choroby mesiace pred rádiologickou detekciou v reálnom čase, čo v ideálnom prípade odďaľuje a predchádza progresii rakoviny súvisiacej s relapsom53.Predbežné výsledky naznačujú, že UCOM odrážajú úroveň rakovinovej hypermetylácie v reálnom čase bezprostredne po operácii a liečbe32.Vysoká citlivosť vykazovaná UCOM a použiteľnosť vo viacerých neintruzívnych typoch vzoriek umožňuje UCOM slúžiť ako presný biomarker na monitorovanie recidívy pri zachovaní vysokej kompliancie pacienta.
Verejná dostupnosť testu je zároveň ďalšou významnou otázkou, ktorá si vyžaduje dodatočné úsilie.Zatiaľ čo spolupráca v oblasti detekcie UCOM bola prijatá vo viacerých nemocniciach v nádeji, že bude prínosom pre viac pacientov, detekcie a skríningy pro bono sa aktívne vykonávajú vo vidieckej Číne.UCOM vyžadujú zlepšenú dostupnosť, aby sa kvalifikovali ako uskutočniteľný skríningový nástroj, najmä pre nedostatočne rozvinuté oblasti.
Zatiaľ čo výsledky aplikácie UCOM pri včasnej detekcii sú sľubné, o UCOM existuje veľa neznámych.Pri aktívnom prieskume je potrebný ďalší výskum o tom, prečo sú UCOM všeobecne prítomné pri rakovine.Základné epigenetické regulačné mechanizmy, ktoré sú základom UCOM, si zaslúžia ďalšie skúmanie, ktoré by mohlo odôvodniť nový smer liečby rakoviny.Keď sa vrátime k súhre medzi homogenitou nádoru a heterogenitou, zaujíma nás, prečo môžu byť UCOM výnimkou z väčšiny biomarkerov rakoviny, ktoré sú úzko spojené so špecifickými typmi rakoviny.Úloha metylačných aberácií DNA identifikovaných UCOM pri tumorigenéze, progresii tumoru a metastázach nebola stanovená v procese straty a znovuzískania bunkovej identity a vyžaduje si dôkladnú kontrolu.Ďalší veľký záujem spočíva v rozsahu začlenenia znaku homogenity UCOM s tkanivovo jedinečnými markermi v nádeji priblíženia sa presnej detekcii stôp rakoviny a identifikácie pôvodu nádorového tkaniva opačným spôsobom.UCOM môžu byť ideálnym nástrojom na prevenciu rakoviny, detekciu rakoviny a potenciálne obranu a odstránenie rakoviny.
Grantovú podporu
Táto práca bola podporená Národným kľúčovým programom výskumu a vývoja Číny (Grant č. 2022BEG01003), Národnou nadáciou pre prírodné vedy Číny (Grant č. 32270645 a 32000505), grantom od Provinčnej zdravotníckej komisie Heilongjiang (Grant č. 2020-111) a grant od Heze Science and Technology Institute (grant č. 2021KJPT07).
Vyhlásenie o konflikte záujmov
Wei Li je riaditeľom výskumu a vývoja pre Shanghai Epiprobe Biotechnology Co., Ltd. Wenqiang Yu je členom Vedeckého poradného výboru spoločnosti Epiprobe.W. Yu a Epiprobe schválili čakajúce patenty súvisiace s touto prácou.Všetci ostatní autori nedeklarujú žiadne konkurenčné záujmy.
Autorské príspevky
Navrhli a navrhli projekt: Chengchen Qian a Wenqiang Yu.
Článok napísal: Chengchen Qian.
Urobil ilustrácie: Chengchen Qian.
Skontrolovali a upravili rukopis: Xiaolong Zou, Wei Li, Yinshan Li a Wenqiang Yu.
Referencie
1. Sung H, Ferlay J, Siegel RL, LaversanneM, Soerjomataram I, Jemal A a kol.Globálna štatistika rakoviny 2020: odhady GLOBOCAN
výskyt a úmrtnosť na celom svete na 36 druhov rakoviny v 185 krajinách.CA Cancer J Clin.2021;71: 209-49.
2. Xia C, Dong X, Li H, Cao M, Sun D, He S a kol.Štatistika rakoviny v Číne a Spojených štátoch, 2022: profily, trendy a determinanty.Chin MedJ (Angl.).2022;135: 584-90.
3. Siegel RL, Miller KD, WagleNS, JemalA.Štatistika rakoviny, 2023. CA Cancer J Clin.2023;73: 17-48.
4. Crosby D, BhatiaS, Brindle KM, Coussens LM, Dive C, Emberton M, et al.Včasné odhalenie rakoviny.Veda.2022;375: eaay9040.
5. Ladabaum U, Dominitz JA, KahiC, Schoen RE.Stratégie pre
skríning kolorektálneho karcinómu.Gastroenterológia.2020;158: 418-32.
6. Tanoue LT, Tanner NT, Gould MK, Silvestri GA.Skríning rakoviny pľúc.Am J Respir Crit Care Med.2015;191: 19-33.
7. Bouvard V, Wentzensen N, Mackie A, Berkhof J, Brotherton J, Giorgi-Rossi P a kol.Pohľad IARC na skríning rakoviny krčka maternice.N EnglJ Med.2021;385: 1908-18.
8. Xue P, Ng MTA, QiaoY.Výzvy kolposkopie na skríning rakoviny krčka maternice v LMIC a riešenia umelou inteligenciou.BMC Med.2020;18: 169.
9. Johnson P, Zhou Q, Dao DY, Lo YMD.Cirkulujúce biomarkery v diagnostike a manažmente hepatocelulárneho karcinómu.Nat Rev Gastroenterol Hepatol.2022;19: 670-81.
10. Van PoppelH, Albreht T, Basu P, HogenhoutR, CollenS, Roobol M. Včasná detekcia rakoviny prostaty založená na PSA v sére v Európe a vo svete: minulosť, súčasnosť a budúcnosť.Nat Rev Urol.2022;19:
562-72.
11. HolyoakeA, O'Sullivan P, Pollock R, Best T, Watanabe J, KajitaY,
a kol.Vývoj multiplexného RNA testu moču na detekciu a stratifikáciu karcinómu z prechodných buniek močového mechúra.Clin Cancer Res.2008;14: 742-9.
12. Feinberg AP, Vogelstein B. Hypometylácia odlišuje gény niektorých ľudských rakovín od ich normálnych náprotivkov.Príroda.1983;301: 89-92.
13. Ng JM, Yu J. Promótorová hypermetylácia nádorových supresorových génov ako potenciálne biomarkery pri kolorektálnom karcinóme.IntJ Mol Sci.2015;16: 2472-96.
14. Esteller M. Cancer epigenomics: DNA methylomes a histón-modifikačné mapy.Nat Rev Genet.2007;8: 286-98.
15. Nishiyama A, Nakanishi M. Navigácia v oblasti metylácie DNA rakoviny.Trendy Genet.2021;37: 1012-27.
16. Xie W, Schultz MD, ListerR, Hou Z, Rajagopal N, Ray P a kol.Epigenomická analýza viaclínovej diferenciácie ľudských embryonálnych kmeňových buniek.Bunka.2013;153: 1134-48.
17. Li Y, Zheng H, Wang Q, Zhou C, WeiL, Liu X a kol.Analýza celého genómu odhaľuje úlohu Polycombu pri podpore hypometylácie metylačných údolí DNA.Genome Biol.2018;19:18.
18. Koch A, JoostenSC, Feng Z, de Ruijter TC, DrahtMX, MelotteV,
a kol.Analýza metylácie DNA pri rakovine: miesto prehodnotené.Nat Rev Clin Oncol.2018;15: 459-66.
19. KleinEA, Richards D, Cohn A, TummalaM, Lapham R, Cosgrove D, a kol.Klinická validácia cieleného testu včasnej detekcie viacerých nádorov na báze metylácie pomocou nezávislého validačného súboru.Ann Oncol.2021;32: 1167-77.
20. Hanahan D., Weinberg RA.Charakteristické znaky rakoviny.Bunka.2000;100: 57-70.
21. Hanahan D. Charakteristické znaky rakoviny: nové dimenzie.Cancer Discov.2022;12: 31-46.
22. Schwartzberg L, Kim ES, Liu D, Schrag D. Presná onkológia: kto, ako, čo, kedy a kedy nie?Kniha Am Soc Clin Oncol Educ.2017: 160-9.
23. Liu H, Meng X, Wang J. Kvantitatívna metylácia v reálnom čase
detekcia génu PAX1 pri skríningu rakoviny krčka maternice.IntJ Gynecol Cancer.2020;30: 1488-92.
24. Imperiale TF, RansohoffDF, Itzkowitz SH, Levin TR, Lavin P, Lidgard GP a kol.Multitargetstool DNA testovanie na kolorektálny skríning rakoviny.N EnglJ Med.2014;370: 1287-97.
25. Li J, Li Y, Li W, Luo H, Xi Y, Dong S a kol.Polohovanie vodidla
sekvenovanie identifikuje aberantné vzory metylácie DNA, ktoré menia identitu buniek a siete imunitného dohľadu nad nádormi.genóm
Res.2019;29: 270-80.
26. Gao Q, LinYP, Li BS, Wang GQ, Dong LQ, Shen BY a kol.Nerušivá detekcia multirakovín pomocou cirkulujúceho bezbunkového metylačného sekvenovania DNA (THUNDER): vývoj a nezávislé validačné štúdie.Ann Oncol.2023;34: 486-95.
27. Dong S, Li W, Wang L, Hu J, Song Y, Zhang B a kol.Gény súvisiace s histónom sú pri rakovine pľúc hypermetylované a hypermetylované
HIST1H4F by mohol slúžiť ako biomarker rakoviny.Cancer Res.2019;79: 6101-12.
28. HeijnsdijkEA, Wever EM, AuvinenA, Hugosson J, Ciatto S, Nelen V a kol.Účinky skríningu prostatického špecifického antigénu na kvalitu života.N EnglJ Med.2012;367: 595-605.
29. LuzakA, Schnell-Inderst P, Bühn S, Mayer-Zitarosa A, Siebert U. Klinická účinnosť skríningových biomarkerových testov rakoviny ponúkaných ako samoplatiteľská zdravotná služba: systematický prehľad.Eur J Verejné zdravie.2016;26: 498-505.
30. Dong S, Lu Q, Xu P, Chen L, Duan X, Mao Z a kol.
Hypermetylovaný PCDHGB7 ako univerzálny marker iba rakoviny a jeho aplikácia pri včasnom skríningu rakoviny krčka maternice.Clin Transl Med.2021;11: e457.
31. Yuan J, Mao Z, Lu Q, Xu P, Wang C, Xu X a kol.Hypermetylovaný PCDHGB7 ako biomarker na včasnú detekciu rakoviny endometria vo vzorkách endometriálnej kefky a cervikálnych škrabkách.Front Mol Biosci.2022;8: 774215.
32. Dong S, Yang Z, Xu P, Zheng W, Zhang B, Fu F a kol.Vzájomne
exkluzívna epigenetická modifikácia na SIX6 s hypermetyláciou na sledovanie prekancerózneho štádia a objavenia sa metastáz.Signal Transduct Target Ther.2022;7:208.
33. Huang L, Guo Z, Wang F, Fu L. Mutácia KRAS: od neliečiteľnej po drogovateľnú pri rakovine.Signal Transduct Target Ther.2021;6: 386.
34. Belinsky SA, Nikula KJ, PalmisanoWA, MichelsR, SaccomannoG, GabrielsonE a kol.Aberantná metylácia p16 (INK4a) je skorá udalosť pri rakovine pľúc a potenciálny biomarker pre včasnú diagnostiku.Proc Natl Acad Sci U SA.1998;95: 11891-6.
35. Robertson KD.Metylácia DNA a ľudské choroby.Nat Rev Genet.2005;6: 597-610.
36. WentzensenN, Walker JL, Gold MA, Smith KM, ZunaRE,
Mathews C, a kol.Viacnásobné biopsie a detekcia prekurzorov rakoviny krčka maternice pri kolposkopii.J Clin Oncol.2015;33: 83-9.
37. De Strooper LM, Meijer CJ, Berkhof J, Hesselink AT, Snijders
PJ, Steenbergen RD, a kol.Analýza metylácie FAM19A4
gén v cervikálnych škrabancoch je vysoko účinný pri detekcii krčka maternice
karcinómy a pokročilé lézie CIN2/3.Cancer Prev Res (Phila).2014;7: 1251-7.
38. Thajský AA, Solomon BJ, Sequist LV, Gainor JF, Heist RS.Rakovina pľúc.Lancet.2021;398: 535-54.
39. Grunnet M, Sorensen JB.Karcinoembryonálny antigén (CEA) ako nádorový marker pri rakovine pľúc.Rakovina pľúc.2012;76: 138-43.
40. Wood DE, KazerooniEA, Baum SL, EapenGA, EttingerDS, Hou L a kol.Skríning rakoviny pľúc, verzia 3.2018, Usmernenia pre klinickú prax NCCN v onkológii.J Natl Compr Canc Netw.2018;16: 412-41.
41. Americká rakovinová spoločnosť.Fakty a čísla o rakovine.Atlanta, GA, USA: American Cancer Society;2023 [aktualizované 1. marca 2023;citované 22. augusta 2023].
42. FonthamETH, Wolf AMD, Church TR, EtzioniR, Flowers CR,
Herzig A, a kol.Skríning rakoviny krčka maternice pre jednotlivcov s priemerným rizikom: aktualizácia usmernenia do roku 2020 od American Cancer Society.CA Cancer J Clin.2020;70: 321-46.
43. Clarke MA, Long BJ, Del Mar MorilloA, Arbyn M, Bakkum-Gamez JN, Wentzensen N. Asociácia rizika rakoviny endometria s postmenopauzálnym krvácaním u žien: systematický prehľad a metaanalýza.JAMA Intern Med.2018;178: 1210-22.
44. Jacobs I, Gentry-Maharaja, Burnell M, ManchandaR, Singh N,
Sharma A, a kol.Citlivosť transvaginálneho ultrazvukového skríningu
pre rakovinu endometria u žien po menopauze: štúdia prípadovej kontroly v rámci kohorty UKCTOCS.Lancet Oncol.2011;12: 38-48.
45. BabjukM, Burger M, CompératEM, Gontero P, MostafidAH,
PalouJ a kol.Usmernenia Európskej asociácie urológie pre neinvazívnu rakovinu močového mechúra (TaT1 a karcinóm in situ) -
Aktualizácia 2019.Eur Urol.2019;76: 639-57.
46. Aragon-Ching JB.Výzvy a pokroky v diagnostike, biológii a liečbe uroteliálnych karcinómov horného traktu a močového mechúra.Urol Oncol.2017;35: 462-4.
47. Rizvi S, KhanSA, Hallemeier CL, Kelley RK, Gores GJ.
Cholangiokarcinóm – vyvíjajúce sa koncepcie a terapeutické stratégie.Nat Rev Clin Oncol.2018;15: 95-111.
48. Ye Q, Ling S, Zheng S, Xu X. Tekutá biopsia v hepatocelulárnom
karcinóm: cirkulujúce nádorové bunky a cirkulujúca nádorová DNA.Mol Cancer.2019;18:114.
49. Zhang Y, Yao Y, Xu Y, Li L, Gong Y, Zhang K a kol.Pan-rakovina
detekcia cirkulujúcej nádorovej DNA u viac ako 10 000 čínskych pacientov.Nat Commun.2021;12:11.
50. Eisenhauer EA, Therasse P, BogaertsJ, Schwartz LH, Sargent D, Ford R a kol.Nové kritériá hodnotenia odpovede u solídnych nádorov: revidované usmernenie RECIST (verzia 1.1).Eur J Cancer.2009;45: 228-47.
51. LitièreS, Collette S, de Vries EG, Seymour L, BogaertsJ.RECIST – učenie sa z minulosti pre budovanie budúcnosti.Nat Rev Clin Oncol.
2017;14: 187-92.
52. Seymour L, BogaertsJ, Perrone A, FordR, Schwartz LH, Mandrekar S, a kol.iRECIST: pokyny pre kritériá odozvy na použitie v štúdiách
testovanie imunoterapeutík.Lancet Oncol.2017;18: e143-52.
53. PantelK, Alix-Panabières C. Kvapalná biopsia a minimálna reziduálna choroba – najnovšie pokroky a dôsledky pre liečbu.Nat Rev Clin Oncol.2019;16: 409-24.
Citujte tento článok ako: Qian C, Zou X, Li W, Li Y, Yu W. Základňa proti rakovine: univerzálne markery iba pre rakovinu.Cancer Biol Med.2023;20: 806-815.
doi: 10.20892/j.issn.2095-3941.2023.0313
Čas odoslania: máj-07-2024